三井研究室
| 指導教員 | 三井敏之 教授 守山裕大 助教 |
|---|---|
| テーマ | 表面科学、生物物理学研究 1.ナノデバイスによるDNAセンシング 2.心筋細胞の同期化メカニズムの研究 3.心臓・血管発生における物理的性質の役割の解明 |
研究内容
実験的に、生体分子と固体との相互作用から細胞・細胞集団と環境変化、そして1個体の発生まで、幅の広い長さのスケールにおいて、生命における現象を物理的な実験手法や解析を適応して、生命の神秘の解明を目指して研究を行っています。
ナノデバイスによるDNAセンシング
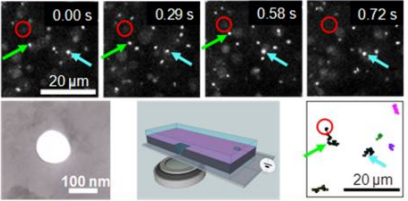
図1. 左図:ナノポアとDNA分子の模式図
上段:DNAを可視化してポア(赤円の中心)に侵入する様子
下段左:ナノポアの透過型電子顕微鏡像
下段中:観測系の模式図
下段右:DNAのポア進入までの軌跡
100万分の1 mmの大きさが1 nm (ナノメートル)で、原子が3~10個ほど並ぶ程度の大きさです。このサイズにおけるものづくりは「ナノテクノロジー」と呼ばれ、90年代より発展しまして、現在では、センサーなど「ナノデバイス」として用いられるようになりました。しかし、ナノのサイズでは、原子・分子の相互作用が顕著に現れます。ナノポアを用いたDNAのセンシングでは、塩基配列の認識が可能になりつつあります。しかし、液中にてポアとDNAとの間には未解明の相互作用があります。
そこで、我々はナノポアや、同じサイズスケールの流路をつくり、DNAの挙動をマイクロサイズで解析して、数値解析を用いてナノサイズにおけるメカニズムの解明を目指しています(図1)。特に数十μm以上の長いDNAはポアに詰まることが知られ、それナノポアのセンシングとしての短所でもあります。我々はその要因がDNA自身の電気的性質にあることを突き止めました。DNAの長さや形状、そして、ポアの幾何によるDNAをポアとの相互作用の変化を、実験的な観測を主に研究を行っています。
心筋細胞の同期化メカニズムの研究
心臓が一定の周期で拍動する理由は、心臓内のペースメーカーとなる心筋細胞が、その“クロックシグナル”を心臓全体に伝搬するからです。個々の心筋細胞の伸縮するタイミングにより、心臓は血流のポンプとして機能するのですが、物理的に考えると、心臓を構成する各パーツの役割は物理的に異なるはずで、その起源は細胞の種類というより、細胞の形状や、1細胞自体の物理的特性の違いによるものです。現在では、生命科学において心臓の各パーツを構成する細胞の中の分子レベルによる違いがわかってきましたが、この違いの起源には様々な説があります。
そこで、我々は物理的な手法も用いて環境が心臓や心臓を構成する細胞に与える影響を、細胞同士の同期化を観測することにより、調査しています。例えば異なるパーツとしての心房と心室の< 1 mmのサイズ(組織片)にして接着すると、最初はそれぞれが独立をして拍動をしますが、10時間程度で同期します。この10時間の間に、それぞれの組織片とその接着面に何かの変化が起こったことになります。同期化のメカニズムは代表的名心臓疾患である不整脈からの回復の過程とも類似しており、医療の基礎研究としても重要な研究です。
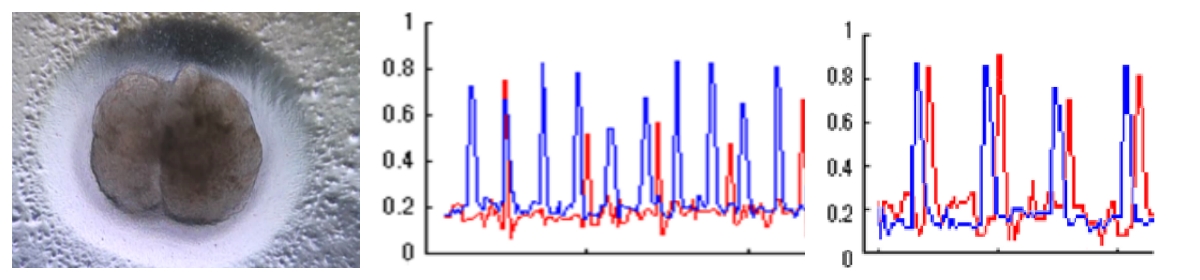
図2.左図:心房と心室の組織片の接着 中図:接着直後は独立に拍動を行う 右図:10時間程度で二つの組織片は同期する
心臓・血管発生における物理的性質の役割の解明
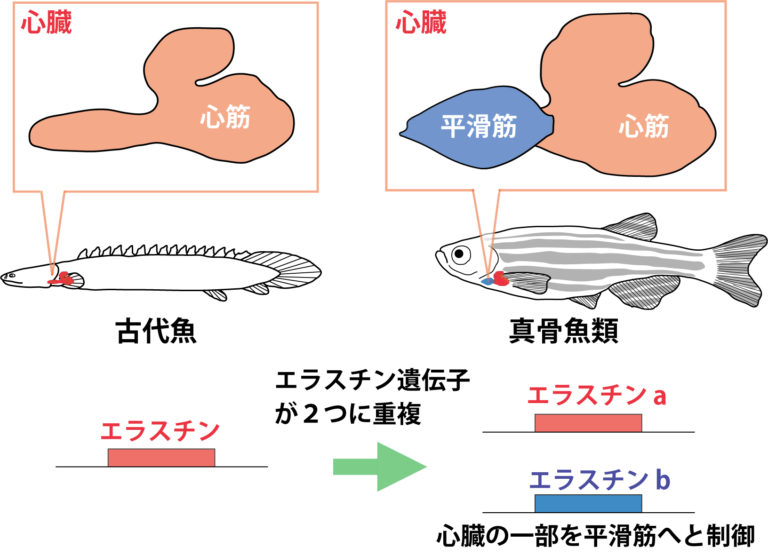
図3. 魚類の心臓進化メカニズム。進化の過程でエラスチン遺伝子が重複し、その一方が細胞外環境を変化させることで心臓形態が変化した(Moriyama et al., Nat Communs 2016より改変)
心臓は胚発生において最も初期に形成され、生物が死に至るまで機能し続けるという、まさに生命そのものと言ってよい重要な器官です。心臓は血液循環を担うことから、その機能は生物種の生理機能に密接に関わっています。そのために進化の過程で著しく変化し、それぞれの生物種が生息する環境に適応するように進化しています。私たちはこれまでにゼブラフィッシュという小型魚類を用いて、心臓を構成する細胞が周囲の硬さ(stiffness)という物理的性質の変化によって進化していることを明らかにしました(Moriyama et al., Nat Communs. 2016、図3)。これを踏まえ、心臓や血管を構成する細胞群がどのようにして周囲の硬さを感知しているのか、また心臓、血管内を流れる血液との間に生じる剪断応力(shear stress)にも着目して、心臓・血管発生における物理的性質の役割について研究しています。
研究の詳細や研究室のメンバーについてはホームページをご覧ください。
参考文献
- Tomoya Kubota, Kent Lloyd, Sakashita Naoto, Seiya Minato, Kentaro Ishida, Toshiyuki Mitsui, (2019) Clog and release, and reverse motions of DNA in a nanopore, Polymers 2019, 11(1), 84.
- Ishida, Kentaro; Saito, Tetsuichiro; Mitsui, Toshiyuki, (2019) Involvement of selective epithelial cell death in the formation of feather buds on a bioengineered skin, Development, Growth & Differentiation, 61(2), 141-149.
- Yuuta Moriyama, Hilda Mardiana Pratiwi, Shogo Ueda and Mikiko Tanaka (2019) Localization of ß-catenin and Islet in the pelvic fin field in zebrafish, Zoological Science, 36(5): 365-371.
- Yuuta Moriyama and Kazuko Koshiba-Takeuchi (2018) Significance of whole-genome duplication on the emergence of evolutionary novelties, Briefings in Functional Genomics, 17(5), 329-338
- Yuuta Moriyama, Fumihiro Ito, Hiroyuki Takeda, Tohru Yano, Masataka Okabe, Shigehiro Kuraku, Fred W. Keeley and Kazuko Koshiba-Takeuchi (2016) Evolution of the fish heart by sub/neofunctionalization of an elastin gene, Nature Communications, 7:10397
研究者情報

| 教授:三井敏之 | |
| 学位 | Ph. D |
| 所属学会 | 日本物理学会、日本応用物理学会、日本生物物理学会、日本生理学界 |
| 研究分野 | ナノデバイス、生物物理、表面科学 |

| 助教:守山裕大 | |
| 学位 | 博士(理学) |
| 所属学会 | 日本発生生物学会、日本動物学会、日本進化学会、The European Society for Evolutionary Developmental Biology |
| 研究分野 | 発生生物学、生物物理学、進化生物学 |
